CRO 임상시험 수탁관리, 유럽 MDR CE 인증, FDA 510(k) 컨설팅 제공하는 케이바이오솔루션(대표 강경윤)는 오는 24일 열리는 국내 최대 전시회 KIMES 2023 전시장의 코엑스 컨퍼런스룸 403호에서 오전 9시부터 오후 6시까지 의료기기 임상연구 설계, 임상시험 프로토콜 계획, 임상전략 및 MDR CE, FDA인허가 전략 세미나를 개최한다고 8일 밝혔다.
세미나 주요 발표자로 나서는 강경윤 대표는 다국적기업 카디널 헬스·세인트쥬드메디칼·쿡메디칼 미국 본사에서 한국인으로써 유일하게 미국 FDA, EU, 아시아 인허가 부장·팀장으로 만13년간 역임한 실무 역량과 전문성을 바탕으로 현재 국내의 Biotech 기업의 CRO임상시험 관리 및 FDA허가 달성에 매진하고 있다.
또한, 강경윤 대표는 존슨앤존슨 미국 캘리포니아 본사 안과수술용 장비들의 MDR CE 컨설팅을 2020년부터 3년간 제공하였다.
아울러 케이바이오솔루션은 (주)메디아나 자동심장충격기 MDR 3등급 의료기기의 보완요청 대응및 임상평가 전략을 마련한 것을 통해 3등급 MDR CE승인을 이끌어낸 바 있다.
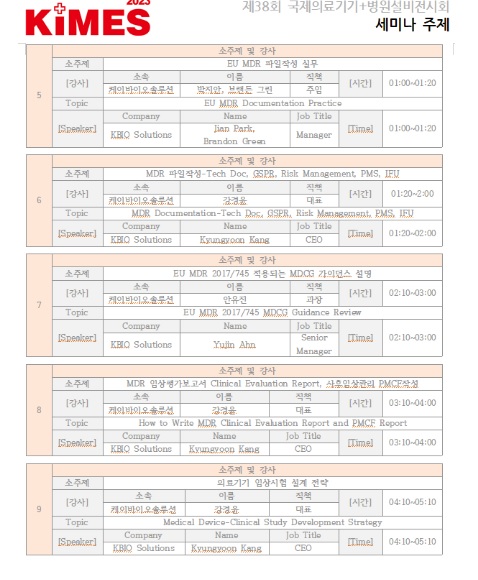
강경윤 대표는 미국 존슨앤존슨 본사 MDR 컨설팅 제공한 것을 비롯해 케이바이오솔루션은 하기 품목군의 20여개 의료기기 개별제품들의 MDR 심사에 제출되는 MDR인증 기술문서 파일들을 작성하는 다수의 국내 기업들과 컨설팅을 진행에 왔다.
이에 케이바이오솔루션은MDR심사를 승인완료까지 진행하는 경험이 국내에서는 제일 많은 것으로 알려져 있다
실제로 케이바이오솔루션는 '성형 봉합사', '성형 수술 임플란트, 레이저조사 피부과 치료기기', '치과 임플란트 엔진, 핸드피스, 토크 드라이버, 포터블 모터기기, 빌트인모터', '치과 임플란트 시술을 위한 메쉬', '자동심장 충격기', '체성분 분석기', '환자 모니터링 기기/AED', '안과 백내장 수술 시스템 장비, 백내장 수술 핸드피스, 백내장 수술팩', '안구건조증 치료 디바이스' 등 다양한 분야에 걸쳐 MDR심사를 진행해 승인을 완료했다.
케이바이오솔루션은 현재까지 20여개 의료기기 제품들의 MDR 심사접수 기술문서 (Technical Documentation)파일을 작성하여 MDR 인증기관 (Notified Body)승인을 받기 위해서 제조사RA, 개발팀과 협력하여 기업에서 MDR문서가 준비가 상당히 안된경우, MDR주요파일들을 직접 주도적으로 작성하는 컨설팅을 제공하고 있다:
참고로 MDR주요파일의 종류로는 인증기관에 제출할 MDR Submission Checklist 작성, 기술문서 Technical Documentation 작성, 안전 성능 체크리스트 General Safety and Performance Requirements 작성, 임상평가 계획서 Clinical Evaluation Plan 작성, 임상평가 보고서 Clinical Evaluation Report 작성, 시판후 임상 조사 계획서 Post-market Surveillance Plan 작성, 시판후 임상 조사 보고서 Post-Market Surveillance Report 작성, 시판후 임상 추적관찰 Post-Market Clinical Follow-up Report 작성, 정기적 안전성 정보 보고서 Periodic Safety Update Report 작성, 위험관리 보고서 Risk Management Report 작성, 위험관리 분석표 FMEA 업데이트, 소프트웨어 기기 경우 소프트웨어 62304 보고서 작성, 소프트웨어 기기경우 소프트웨어 개발 SRS, SDS, 소프트웨어 성능시험 보고서 작성, 멸균의료기기 경우 생물학적 안전성 보고서 작성, 사용 매뉴얼 IFU에 포함될 MDR요건사항 추가 업데이트, 자가선언서 Declaration of Conformity 작성 등이 있다.